һ������
��ָ��ԭ�t��Ҫᘌ�ע�䄩�c�������b�������������о��M���U���������ּ��ָ��ˎƷ�аl(f��)�����a(ch��n)��I(y��)ϵ�y(t��ng)���Ҏ(gu��)�����M��ˎƷ�c�������b�������������о�����ˎƷ�аl(f��)���g��ˎ�ò��������º��Q���������b�����M���x���������������аl(f��)�^���Ќ����WˎƷע�䄩���bϵ�y(t��ng)���m�����M�д_�J���������K�x���ʹ���cˎƷ�������������ԵIJ������b������������ˎ�ð��b�������܌��µİ�ȫ���L�U������
��ָ��ԭ�t���ڬF(xi��n)�з�Ҏ(gu��)�͘˜��wϵ�Լ���ǰ�J֪ˮƽ���ƶ��������ѭ�ˡ�ֱ�ӽ��|ˎƷ�����b���Ϻ����������k����������ʳƷˎƷ�O(ji��n)�����������13̖��������/������ԭ����ʳƷˎƷ�O(ji��n)���������l(f��)���ġ����WˎƷע�䄩�c���ϰ��b�����������о����gָ��ԭ�t��ԇ�У�������ʳˎ�O(ji��n)ע��2012��267̖����˼·����������b�ˇ���(n��i)�����P��ָ��ԭ�t�����P������������cͻ����ע�䄩�c�������b�������P���������о���(n��i)��������S�����P��Ҏ(gu��)�IJ��������Լ�ˎ���о����gҪ�����ߣ���ָ��ԭ�t��������ӆ���������
��ָ��ԭ�t��Ҫ�U����ע�䄩�c�������b�������������о������������c�������b�������������о����ڱ�ָ��ԭ�t��Ԕ��������������������������b�������c�z���ȽM�����ʹ���������ˎƷ�аl(f��)�����a(ch��n)��I(y��)�Ʌ������Pָ��ԭ�t�Ļ���˼·������_չ�Ƅ��c�������b���������M�������ϣ����z���ȣ����������о���
��ָ��ԭ�t�ǻ���Ŀǰ�J֪�Ŀ��]��������������罛(j��ng)��C�ƌW����Ҳ�ɲ��������
�����������о��Ŀ��]Ҫ�c
2.1 �����ķ��
Ŀǰ������Ї�����ISO 12775:1997��E������������������(j��)����������B2O3��������ƽ��������Ûϵ��(sh��)��Coefficient of Mean Linear Thermal Expansion������QCOE���IJ�ͬ�������֞�������貣�����c�}����������Ќ���貣���ַ֞����貣��������貣����������貣�����總��1��ʾ����
�����������W���Լ��ձ��������ķ���c�҇���ͬ��������˼·����һ���������總��2��ʾ�����
2.2 ע�䄩�c�������b�������ܰl(f��)���������
2.2.1 ���������Ļ��W�ɷ��c���a(ch��n)��ˇ
һ����f������ˎ�ò���ͨ����������������������������������������������X�������c��������������������}����������V�ȳɷ֡�ÿ�N�ɷֱ��������㶨�������һ��������(n��i)������������ͬ�������a(ch��n)��I(y��)�IJ������W�M�ɕ�������ͬ�����
���˸���ˎ�ò�������������ͨ�����ڲ��������Ӳ�ͬ����������������������c���������⛡������}����������^����������\����������������ͷ�����ɽ��Ͳ������ۻ��ضȺ�/����Ʋ�����(n��i)����������������������������X���Ը��M���������W������������F����i��⁵��^�ɽ����������γ���ɫ�����Ԯa(ch��n)���ڹ�Ч���������������������������R�����|(zh��)�Գ�ȥ�����К����������Ӳ����ij���������ˣ������еĽ����x�ӻ���x�ӈF���п��IJ������w�Ƴ�������
�������b����ͨ������ģ�ƺ��ƹ�ˇ���a(ch��n)���������ͬ���a(ch��n)��ˇ��������Ʒ�|(zh��)����Ӱ푲�ͬ���e�nj�������(n��i)�����������Ӱ��^���������ģ�Ʋ���������(n��i)���������Ի�����ͬ������������Ʋ����ƳɵIJ�ͬ��Ͳ����������������ע�䄩ƿ����Q����ƿ�������곡��Pʽע����������Ͳ����Q����ƿ���������A���ע��������ᘹܵȣ�ͨ�^�ӟ�ʹ�������͵��^�����������ھֲ��ܟᣨ��ײ������h(hu��n)��λ������i��������ĉA���ٺ������}�����l(f��)�������ԭ���������������λ��(n��i)����Ļ��W������ͨ�����ڲ���������δ�ܟ�IJ�λ������������������ͬ�S�ҿ����x��ͬ�Ĺ��Ƴ���ˇ�����ײ����i������ӹ��ض��Լ��γɲ�����������˻�ض��������˻�r�g�Ȳ�ͬ����˼�ʹ������ͬ���a(ch��n)���ṩ��ͬ���β���������������Ʋ�������Ҳ���ܴ����|(zh��)����������o�����b��ˎ�����ͬ���L�U�����
������߲���������(n��i)������ˮ�Ե������������ͨ���������������ă�(n��i)�����M�����W̎�����������������@̎����ԓ̎����ˇ�mȻ������߲�������ˮ������������ܕ�ʹijЩ�������Y(ji��)������������������Ҳ�����������������Ã�(n��i)�����Ĥ̎���ķ�ʽ�������ע������������ˎƷ�L���A�ؗl����������Ĥ�Ӳ��Ͽ��ܱ�ˎ�����g���Ĥ�Ӳ��ϼ������ɷ־������w���M��ˎ���С�
2.2.2 ע�䄩�c�������b�����������
ע�䄩��ˎ���c�������b�����ɰl(f��)���������W�����������Ҋ�ķ����У�ijЩˎ�����������A��������x�ӵ�����������������еĽ����x�Ӻ�/���Ĥ�ɷ��w���M��ˎҺ���ɴ�ˎ��l(f��)��ijЩ���ⷴ���������������Һ�ɫ����������a(ch��n)��������������F(xi��n)��Ҋ���ˎ�オ���ٶȼӿ�ȬF(xi��n)�����������е��c�x���w�ƺ����������ˎҺpHֵ�l(f��)��׃���������ijЩ�����^��Ľ����x�ӻ���x�ӻ��F�w���M��ˎҺҲ���a(ch��n)�����ڵİ�ȫ���L�U���
����ijЩ���������ί���խ����Y(ji��)���ϴ������c�����l(f��)���������܈F��ˎ���������̎���к������������o�ϣ��翹����������j�τ�����ˎ�������������������ܕ��a(ch��n)�����������������ʹˎ������o�Ϻ�����������
ע�䄩����������(n��i)����������Ԯa(ch��n)��Ӱ����������Ͳ��������ı��o���ú�����������������²����W(w��ng)��Y(ji��)���Ɖ���ʹ���еijɷִ����ܳ����a(ch��n)������м��ÓƬ�������l(f��)��ȫ�Ԇ��}������Ӱ푲�����(n��i)���������Ե����ذ������������Ļ��W�M�ɡ����a(ch��n)��ˇ����������ͺ��̎����ʽ���Լ�ˎ���Ƅ���̎�����M�ɳɷ��������x�ӏ��ȡ��j�τ�������pHֵ���������ʽ��������ģ�Ʋ�������������ă�(n��i)���������Ի�����ͬ�����Ʋ������������ײ������h(hu��n)��λ���i����(n��i)����Ļ��W�����Ե���������λ��������g���ܲ�ͬˎ���Ƅ���Ӱ��^���������(n��i)���潛(j��ng)�^̎���������������@̎�����IJ������܌��±���Ӹ��裬����ɲ����Y(ji��)�����������
Ӱ푲�����(n��i)���������Ե����ؿɅ�Ҋ����3������
2.2.3 ��ע�䄩�x���m�˵IJ������b����
��ָ��ԭ�t��ָ�IJ������b�������w��ģ��ݔҺƿ��ע�䄩ƿ���Լ�����ע�䄩ƿ���������������Pʽע����������Ͳ���A���ע��������ᘹܵ�����
ͨ��������ˎ�ò��������^�õ�����������W��(w��n)���ԣ����ﰲȫ�������^��������ڞ�ע�䄩�x�������b�����r���������Ҫ�Pע���������ı��o������������������������ȫ���������Լ��c��ˇ���m���Ե�������
�������Է��棬�迼���Ƅ��������������ܵ�Ӱ��������Լ������������Ƅ��|(zh��)���Ͱ�ȫ�Ե�Ӱ푣����Pע���·����(n��i)�ݣ���������������������Ļ��W�M�ɡ��������������a(ch��n)��ˇ���Ҏ(gu��)���С���������ͺ��̎����ʽ���ˎƷ��̎�������|(zh��)����ˎҺ��pHֵ�����x�ӏ��ȵ��������Լ��Ƅ����a(ch��n)�^���е���ϴ����������ȹ�ˇ������������Ӱ������ϴƿ�A�εĸɟ�����ˇ���Ƅ�������﹤ˇ�������K�˜����ˇ������
һ����r������������Ʋ����������m���ڰ��bС����ע��Һ�Լ���ĩ������簲�ƿ�����Pʽע����������Ͳ���A���ע������������ģ�Ʋ����������m���ڴ�����ע�䄩�����С����ע��Һ�ͷ�ĩ��ģ��ע�䄩ƿ���İ��b���������c�}����ݔҺƿ������貣��ݔҺƿ�������
2.3 ��������IJ��E
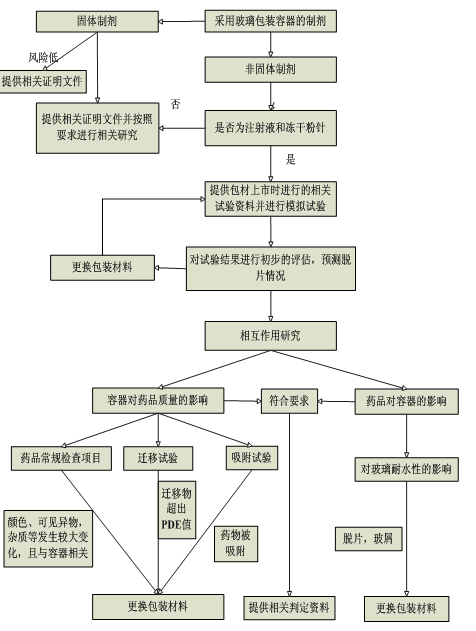
�������о���(n��i)�ݑ��������b������ˎƷ��Ӱ��Լ�ˎƷ�����b������Ӱ����������Ҫ�֞������������E��1���_��ֱ�ӽ��|ˎƷ�İ��b�M���������2���˽��������b�M�����ϵĽM���������b�M���cˎƷ�Ľ��|��ʽ�c���|�l���������a(ch��n)��ˇ�^�������磺�������������a(ch��n)��ˇ��ģ�ƻ���ƣ����������������������ͺ��̎���������������������(j��)ע�䄩���������|(zh��)���M�x��IJ��������M�г����u����3�����������b�M��ģ�Mԇ���������A�y���������Ƿ���a(ch��n)��ÓƬ�Լ��������}����4���M���Ƅ��c���b����ϵ�y(t��ng)��������о���������Ҫ���첣��������ˎƷ��Ӱ��Լ�ˎƷ������������Ӱ����������M��ˎƷ��Ҏ(gu��)�z���Ŀ�z�顢�w��ԇ��������ԇͬ�r��������(n��i)��������g���M�п������5����ԇ�Y(ji��)���M�з�������ȫ���u����/���о��������6����ˎƷ�c���ð��b���ϵ��������M�п��Y(ji��)�������ó����bϵ�y(t��ng)�Ƿ��m����ˎƷ�ĽY(ji��)Փ�������������������о��Q�ߘ�Ʌ�Ҋ����4���
�������������о�����Ҫ��(n��i)���c��������
���M��ע�䄩�c�����������������о�ǰ��������Ҫ�˽ⲣ���ĽM�ɳɷ֡����a(ch��n)��ˇ��������(n��i)����̎����ʽ����Ϣ��Ȼ���ڴ˻��A֮���M�к��m(x��)���������о�����
�@����������о�����ģ�Mԇ��������о����
3.1 ģ�Mԇ�
ģ�Mԇ����ҪĿ�����A�y���������l(f��)��ÓƬ�Ŀ����ԣ�ͨ������ģ�MˎƷ���܄�������^���ҵėl���£����������b�M�е�ԇ��о������
���ע�䄩���ڶ�N���bҎ(gu��)������ԇ��о����������x�ȱ���e���IJ������������ע�⣬����Dz�ͬ�Ĺ����̺ͣ���ͬ���|(zh��)�IJ������b������քe�M��ԇ
ģ�M�܄������x��Ŀ��ˎ���ע�䄩��������ˎ����������a(ch��n)���ɔ_��������x���c�Ƅ�������ͬ�������������|(zh��)��ģ�M�܄������c���]��Һ��pH������O�Լ��x�ӏ����������x�ӷN�������粻��ˎ��Ŀհ��Ƅ���ģ�M�l����ģ�Mԇ������^���ҵėl�����M����������Y(ji��)��ˎƷ�����a(ch��n)����A���������\ݔ��ʹ���^���е���O�˗l�������x������ҵ�ԇ�l�������ӟ��������������������ʎ�����
�����x������ģ�M�܄���ģ�M�l�����������Ҳ�Ʌ�������ˎ��<1660>������(n��i)�����������u��ָ���м���ÓƬԇ�����總��5��ʾ������������Y(ji��)��ˎƷ��pHֵ��������x�ӏ��ȵ�����������x��ģ�M�܄���ģ�M�l�����
��������������(n��i)�����M�Йz�飬�������g���ģ�M��Һ�M�Йz�y�������������A�y������(n��i)���港�g�Լ�����ÓƬ�ăA�����������ͨ�^�^�첣����������g���E�M�г����Д������������y��ָ�˰���ԇ�Һ��SiԪ�؝������������Si/B��Si/Al��ֵ��������������Ҋ�Ͳ���Ҋ����(sh��)����������pHֵ�����̶��������Լ�������N�x�ӵ�׃�����ȡ�
3.2 ������о�
�M��ע�䄩�c��������������о��r���������ÔM���е�̎����ˇ�Ͱ��b�������a(ch��n)���Ƅ��������������������Լ�ע�䄩������ԇ��Ʒ��������������3���Ƅ��c1�����b�����M���о�����
����l�����ֿ��]ˎƷ���A�桢�\ݔ��ʹ���^���п������R����O�˗l��������������r�g�c���O�Ñ����ڌ��������b�������|(zh��)���J�R�����b�����cˎƷ�Ӱ푵�څ�ݶ��O�������һ�㑪�����ڣ�0����3���6���£�����ԇ��c���ͨ�����x���������l�����a(ch��n)�����b�������õ�ע�䄩�İ��b�����������Ǹ����b�M�����M��������о���������Ʌ������ٷ�(w��n)����ԇ��Լ��L�ڷ�(w��n)����ԇ��ԇ�l�����ضȺ͕r�g�����������ّ��������c�ͽK�c�����g�c���m���{(di��o)���������磬�ڿ����x�ӝ�ȵ�׃����r�r�������ʹ�x�ӝ��-�r�g������б��׃���Y(ji��)�����߿��u�r�ԣ����m���������gȡ���c����������˱M���ܱ��C��Һ�c���������ײ������h(hu��n)��λ�ͼ粿���|�����������ע��Һ�����ɲ������������͵��õķ�ʽ�M�зքeԇ����
�ڌ���ͬ��ȵ�ע�䄩�M���о��r��Ҳ�ɲ���ICH��(w��n)����ָ��ԭ�t�����]����̖�����ꇷ��M��ԇ����
3.2.1 ����������ˎƷ�|(zh��)����Ӱ�
3.2.1.1 ˎƷ��Ҏ(gu��)�z���Ŀ
�ڲ�ͬ�Ŀ���l���͕r�g�c��ˎƷ�M�Йz��r�������c�Pע�������������������|(zh��)��ˎ�ﷀ(w��n)���Ե�Ӱ�����猦ˎƷpHֵ����Һ������c�ɫ�����Ҋ�����������������ؽ�������������P���|(zh��)�ͺ����ȵ�Ӱ�������Ʌ���ˎƷ�˜��M�Йz��pHֵ�^���е�ˎƷ������������c�Pע�IJ����н����ĉA�����x�ӵȳɷ�ˎƷ��(w��n)���Ե�Ӱ��������ˎƷpHֵ����ˎҺ�ɫ��׃����r��������Ҋ����ij��F(xi��n)���������
3.2.1.2 �w��ԇ�
�������b�����нM�ֶ���o�C�}����w����ע�䄩ˎҺ�ij�ҊԪ�ذ���Si��Na���K��Li�����Al���Ba��Ca������Mg��B����Fe������Zn��Mn���Cd��Ti������Co��Cr���Pb��As����Sb������������Y(ji��)���ض����������ĽM���Լ��������|(zh��)����Ϣ���������е��x���M�ж����z�鲢�M�а�ȫ���u��������c������6����Ԫ�صęz�y�Y(ji��)���M���u���������������߀�茦ˎҺ��Si������B���Al�ȿ��Aʾ���������g��a(ch��n)��ÓƬڅ�ݵ�Ԫ���M�Йz�顣
���ڃ�(n��i)�����Ĥ�IJ��������������Ĥ�Ӳ��ϵĽM�ּ��併������w��ͬ�r�M�п��졣
3.2.1.3 ����ԇ�
����ԇ���Ҫᘌ���������ί���խ��������Y(ji��)���ϴ������c�����l(f��)
�������Ĺ��܈F��ˎ�������Լ�̎���к������Ĺ������o���M��������]�x��ԓˎƷ����ԇ��Լ��L������ԇ�l�����ضȺ͕r�g���M�������ͨ�������x�����ԇ��Լ��L������ԇ�Ŀ���r�g�c�������ˎƷ�˜��M�Йz������(j��)���쌦���繦�����o�ϣ����m�����әz��Ŀ���������Ҫ��ˎƷ�Լ��M�����o�ϵĺ������Ŀ�M�Йz�������
3.2.2 ˎƷ������������(n��i)�����Ӱ�
���ں��ЙC��������j�τ���ƫ�A�������x�ӏ��ȵ�ע�䄩���總��3��ʾ�����������c�Pע�������������g����F(xi��n)ÓƬ���������м���Ŀ����ԡ����������ģ�Mԇ���w��ԇ��ͬ�r��������������(n��i)����ÓƬ��څ�ݺͳ̶��M�п������������ԓע���������ˎƷ�����������i���͵ײ����ͼӹ�̎�����g�̶��cˎƷ�������ڵ����g�̶Ȳ�ͬ��������������cˎƷ���|̎�c�ǽ��|̎�����g�̶�Ҳ��ͬ��������Ƅ����������ڿ���ˎƷ������������(n��i)�����Ӱ푕r����ע�⌦����������ͬ��λ�M�п�������
��ͨ�^������������(n��i)���漰/��ע��Һ�M�Йz�y������������u��ˎƷ������������(n��i)�����Ӱ����������Ҋ�ķ���������Ҏ(gu��)�^�첣���������g���E����������(n��i)�����M�Ё����{Ⱦɫ�ȣ���������Լ�ע��Һ�еĿ�Ҋ������ñ���������g��������(n��i)����Ļ��W���g�M�Йz�y��������y��ע��Һ�еIJ������������Լ�ԇ�Һ��SiԪ�؝���������������Si/B��Si/Al��ֵ׃���Լ����������x�ӵ�׃��څ�ݵ��M�п�������������(sh��)ֵ��l(f��)���@��׃�������t�Aʾ�����������������g�a(ch��n)��ÓƬ��������м�����L�U��������
���M�в�������������r����Ʌ����Ї�ˎ�丽�IX C�M�Йz�顣���������܄�����������e���������ײ�����������˵õ��ʴ_��(sh��)��(j��)�������������Һ�M�г����u���M�Мy������
��ԓע������������������a(ch��n)��ÓƬ�ăA���cʢ�bע��Һ�ĕr�g�L��ֱ�����P�����ͨ����ʢ�bע��Һ3��6�����Ժ���߸��L�r�g�ſ��^�쵽���@��ÓƬ�F(xi��n)�����_ˎƷ��������(n��i)�����Ӱ��������m�����L����ĕr�g�����������ˎƷ����ԇ����M��9��12����ԇ����������L������ԇ��^�����M�п������
���ڿ�Ҋ������Ҋ���z�������Ҫ��ע��Һ���x�ӝ�Ȱl(f��)���@��׃������r���ɲ����m�˷������������������z�鷽���y�ԙz����������С�����M�п������������������������g�a(ch��n)��ÓƬ��������м�����L�U��څ���M�з������u����
3.3 �հɔ_ԇ�
��Ҫ�r���M�пհɔ_ԇ�,ԇ��^���������õ�ԇ�����������Լ��M�Ѕ���ԇ�r������ԭ�t�ϑ��M������ʹ�ò��������������ⲣ�����Ķ��c�z�����ʹ���������M��������ԇ�r��������]�����z����ԇ�Y(ji��)����Ӱ푡�
���磺�ڌ��������b�����M�����Pԇ�r�����հ�ԇ���x�����z�������ܷ���������x����ķ���ϩƿ�����Լ����ķ���ϩ��۱�ϩ���������������������M��ƽ�Ќ��ա�
3.4 ���������c�����W��C
ģ�Mԇ���w��ԇ���Ì����ԏ��������ʴ_��������������`���ķ�������������Ա��Cԇ�Y(ji��)���Ŀɿ����������ᘌ���ͬ�Ĵ��y�Ŀ�x���m�˵ķ�����������������ڲ��������Ҋ�Ŀ���ȡ�������x����������]�l(f��)�����|(zh��)�ȽM�֣�������ȡ��ͽ�����ij�Ҋ��������������늸���ϵ��x���w�l(f��)����V��ICP�����ԭ�����չ��V��AAS�����x��ɫ�V��IC���������ЧҺ��ɫ�V��HPLC�������Լ��c�|(zh��)�V��(li��n)�C���g�����ICP-MS����HPLC-MS�������������W�о��r���c�Pע�`���ȣ��z�y�������������ֵ����������ԡ��ʴ_�Ե�������
����ˎƷ��������(n��i)����Ӱ푵ķ��������^���������Ʌ���ˎ�䷽���M�в�������������Ҋ����z������������x�����������x����������@�R-X�侀����ɫɢ���V�x��SEM-EDX�������M�Йz���������Ҳ���x���ָ�����@�R��DIC�@�R�������������@�R��EM���Լ������x���|(zh��)�V�x��SIMS���Լ�ԭ�����@�R��AFM������������̽ᘣ�EPMA���ȷ�����������������g�̶��Լ����܌ӵĻ��W�M���M�п����������
ԇ��^������ע�⣺�M��ģ�Mԇ���w��ԇ�r����M�з����W��C�������Ŀ��Ԫ�صĻ����ʑ�����Ҫ�������������ԇ�ķ����`���ȑ��M��AET�Ĝy��Ҫ�����������Мyԇ�Ŀ���ύ���нy(t��ng)Ӌ�W���x�Ĕ�(sh��)��(j��)��
���������ԇ�Y(ji��)�������c��ȫ���u��
����(j��)ģ�Mԇ�Y(ji��)��������������ʢ�b���HˎҺ�r�l(f��)��ÓƬ�Ŀ������M�г����A�y������ͨ�^��ˎƷ��Ҏ(gu��)�Ŀ�z�锵(sh��)��(j��)���w��ԇ��н�����ķN������������ԇ��Լ�ˎƷ��������(n��i)�����Ӱ��M���u���������Д���bϵ�y(t��ng)�Ƿ��cˎƷ����������������
4.1 ģ�Mԇ�Y(ji��)���u��
���ԇ��^���У�������(n��i)������F(xi��n)���g���E����������ԇ�Һ��SiԪ�؝�ȡ�Si/B��Si/Al��ֵ�������(sh��)�Լ�pHֵ�Ȱl(f��)���@��׃�����t�Aʾ���������l(f��)��ÓƬ�Ŀ������^�������
��ע���������ģ�Mԇ�H���A�y���������l(f��)��ÓƬ�Ŀ��������������ʢ�b���Hˎ��r����һ�����l(f��)��ÓƬ�������������Ɍ�ģ�Mԇ�Y(ji��)���M���u����������x���^�m(x��)�M�к��m(x��)������ԇ�߀�Ǹ��Q���b�����Ĺ����̺�/�������Nİ��b������
4.2 ˎƷ��Ҏ(gu��)�Ŀ�z��Y(ji��)���u��
���ԇ�l(f��)�F(xi��n)���F(xi��n)��Һ�ɫ�����������a(ch��n)����Ҋ���pHֵ׃���ȬF(xi��n)���������������ԭ��ԇ�Y(ji��)���M���u����������������׃�����_�����ɽ��ܵij̶�����Ҟ鲣���������£������]����������Ͳ������b�����Լ�������ʽ�İ��b�������������������ԭ�����£������a(ch��n)Ʒ�M�Ѓ�(y��u)���������������Ƅ���̎����ˇ����ʹ�a(ch��n)Ʒ�������P�|(zh��)������Ҫ��
4.3 �w��ԇ�Y(ji��)���u��
����(j��)�������PDEֵ�����ÿ�������ˎ����Ӌ��ÿ�����b
�����и��������������S�������������ڴ˻��A�Ͻ�(j��ng)Ӌ��õ������u�r�ֵ��Analytical Evaluation Threshold������AET��������������yԇ�������M��ԓAETֵ�Ĝy��Ҫ��
���ύע���Y�ϕr�������ṩ�������PDE������AET�Ȕ�(sh��)ֵ����Ӌ���^�̡�
����w��ԇ��@ʾ�����ﺬ������PDE�r����������J����������������׃ˎƷ�İ�ȫ��������������ߵİ�ȫ���L�UС���
����w��ԇ��@ʾ������ĺ�������PDE���t�J����b�����cˎƷ������������������h���Q���b���ϡ�
���������г��ý���Ԫ�أ�ע��;������ÿ�����S�z������PDE��Ո��Ҋ����6�������
4.4 ����ԇ�Y(ji��)���u��
�������ԇ�Y(ji��)���@ʾ���b������ˎƷ���o�ϴ����^����������������ˎƷ�|(zh��)���a(ch��n)�����@��Ӱ��������h�����m�˵ķ����������a(ch��n)Ʒ�|(zh��)����Ӱ�����������磬���Q���b���������
4.5 ˎƷ��������(n��i)�����Ӱ푽Y(ji��)���u��
��ģ�Mԇ���w��ԇ��^�����������������^�첣��������F(xi��n)���g���E�����߳��F(xi��n)��м����ÓƬ�������������ۿ�Ҋ�Լ�����Ҋ���Ĕ�(sh��)������ˎ�����Ҫ�t��ʾˎƷ�|(zh��)���ѽ�(j��ng)�a(ch��n)�����@��Ӱ��������h���Q���b�������
�����Ҋ������Ҋ���z�������Ҫ����Һ��SiO2������Si/B��Si/Al��ֵ�l(f��)���@��׃������ʾ���������a(ch��n)��ÓƬ��������м�����L�U��څ���������������^�m(x��)�_չ���P�о������������m(x��)�O(ji��n)�y����������(n��i)�����׃���������߸��Q���b��������
���������~���
ˎ�ò������������û��W��(w��n)���Ժ���������������ܷ�(w��n)���A���t(y��)ˎ�a(ch��n)Ʒ�IJ������ϻ���Ʒ������
���Ʋ����������ģ�Ʋ����������ǰ��������ͷ��������������ķ������ģ��ƿ�ǽ������N��ͬ�Π��ģ�߳��͵Įa(ch��n)Ʒ���������Ʋ����������������Ƴ��͵ĸ�����ܶ��μӹ����͵Įa(ch��n)Ʒ��
������(n��i)������ˮ�ԣ���һ�N����ԇ�����������Ҏ(gu��)����ˮע�뱻�y������Ҏ(gu��)������������������Ҏ(gu��)���ض�����r�g���M��̎�������ͨ�^�ζ�����Һ��y��ˮ��������(n��i)��������g�̶ȡ�
������(n��i)���������ԣ�ָ��������������b��(n��i)�������g���������(n��i)�������ˮ������ᡢ�A�����|(zh��)������������W���g�Լ��ضȡ������ȭh(hu��n)���������õ������
ƽ��������Ûϵ��(sh��)����Coefficient of Mean Linear Thermal Expansion�����QCOE����ƽ��������Ûϵ��(sh��)�Dz�����Ҫ�ğ�W���|(zh��)���������ָ�ض�����1���������λ�L���ϵ����L�������
����̎��������߲��������ijЩ���܌��������������M��̎���Ĺ�ˇ���������p����Ʒ�A�����x�ӵ����Ի�̎���������������Ʒ������ˮ�ԵĹ軯�Ĥ�ȡ�
�Ĥ���������׃���������ijЩ�������ͨ�^��ͬ���Ĥ��ˇ�o����������(n��i)���渲������Ļ��W�ɷ֣��绯�W������eVCD��������(j��ng)�^һ���Ĺ�ˇʹ���c������Ʒ���Y(ji��)һ�w���������(j��)Ĥ�ӵijɷֲ�ͬ�֞��ЙC���Ĥ�����͟o�C���Ĥ���������
ÓƬ��������(n��i)����ĉA�����x������Һ���W���g���ڲ��������γ�һ�Ӹ߹���������߹������c������(n��i)����δ׃�|(zh��)������Ûϵ��(sh��)��ͬ���ڜض�׃���r����֮�g���a(ch��n)�������������¸߹����ӏ����w������Ó�䵽��Һ���γɲ���ÓƬ�ĬF(xi��n)�����������ԭ�����⣬Ҳ���ܴ����������²���ÓƬ�������������
��ÿ�����S��¶����permitted daily exposure, PDE����ָijһ���|(zh��)�����S�z������a(ch��n)�����Ե���ƽ�������������ijһ���w���|(zh��)��PDEֵ���ɲ��a(ch��n)���������������w���{(di��o)��ϵ��(sh��)�����N��֮�g���ϵ��(sh��)���������w������ڽ��|���Զ����о��Ŀ�׃ϵ��(sh��)���������������
�����u�r�ֵ��Analytical Evaluation Threshold AET��������(j��)��ÿ�����S���¶����ȫ���ֵ/���ֵ����ˎ�����Լ��Ƅ����b���c��Ӌ��ÿ�����b�������ض��Ŀ���ȡ���/������ﺬ�����������һ���ض��Ŀ���ȡ���/�������ˮƽ�_�����^�@����ֵ�r���������Ҫ�_ʼ���@������ȡ��/�������M�з������������Ҫ���o���P���T�Ա��_ʼ�M�а�ȫ���u����
����������
����1���Ї����Ҙ˜ʌ������ķ����r
���W�M�ɼ����� | �� �� � �� |
����貣�� | ����貣�� | ����貣�� | �c�}���� |
B2O3��%�� | ��12 | ��8 | ��5 | <5 |
SiO2*��%�� | �s81 | �s75 | �s71 | �s70 |
Na2O+K2O*��%�� | �s4 | 4-8 | �s11.5 | 12-16 |
MgO+CaO+BaO+��SrO��*��%�� | / | �s5 | �s5.5 | �s12 |
Al2O3*��%�� | 2��3 | 2��7 | 3��6 | 0��3.5 |
ƽ��������Ûϵ��(sh��)1����10-6K-1 ��20��300���� | 3.2��3.4 | 3.5��6.1 | 6.2��7.5 | 7.6��9.0 |
121���w����ˮ��2 | 1�� | 1�� | 1�� | 2�� |
98���w����ˮ��3 | HGB1�� | HGB1�� | HGB 1����HGB 2�� | HGB 2���� HGB 3�� |
��(n��i)������ˮ��4 | HC1�� | HC1�� | HC1����HCB�� | HC2����HC3�� |
�������� | ������ | 1�� | 1�� | 1�� | 1��2�� |
ԭ�����շֹ��ȷ� | 100��g/dm2 | 100��g/dm2 | / | / |
�͉A���� | 2�� | 2�� | 2�� | 2�� |
����2���������W���Լ��ձ��������ķ��
 ���һ� ���һ�
�C��  ����� �����
�Pϵ ��; | ASTM-E438 | USP | EP | �ձ� | ��(n��i)������ˮ�� |
ע�估���� | I Class A | 1 | I | 1 | 1 |
ע�� | I Class B | 1 | I | 1 | 1 |
�ڷ���ԇ�� | II Class | 2 | II | 2 | 2 |
�ɷۼ��̈́� | III Class A | 2 | III | 2 | 2 |
����3��Ӱ푲�����(n��i)���������Ե�����
���������ĽM�ɳɷ���������a(ch��n)��ˇ | �����������ͺ��̎����ˇ�Լ�����l�� | ˎ�� |
�������M�� ��ģ�ƻ��߹����Ƃ乤ˇ �����a(ch��n)�^�̣� -�����ٶ� -���͜ض� | �����ͺ��̎���� -�����@ ������l���� -�ߝ� | ��ԭ��ˎ ���Ƅ�̎���� -�����}������������}�������}���_Һ -�ЙC����c�}���������������}�������R�����}���������}�������ʯ���} -���x�ӏ����������>0.1M�ĉA�����} -��λԇ��������EDTA -��pHֵ��> 8.0�� ���K�˜�� ����ʾ�ă���l������ػ�ɿ��Ҝأ� �����|(zh��)���� |
����4�����������������о��Q�ߘ�
����5������ÓƬ�Ľ��|(zh��)�͗l��������ˎ��<1660>������(n��i)
�����������u��ָ�ϣ�
���|(zh��) | 0.9%KCl��Һ pH8.0 | 3%�ۙ����c��Һ pH8.0 | 20mM�ʰ�����Һ pH10.0 |
�l�� | 121�������2hr | 80���������24hr | 50�����24hr |
����6�����������г��ý���Ԫ�ص�ÿ�����S�z������ע��;����
����Ԫ�� | PDE |
Pb | 5��g/day |
Co | 5��g/day |
Cd | 2��g/day |
As | 15��g/day |
Li | 250��g/day |
Sb | 90��g/day |
Ba | 700��g/day |
Fe | 1300��g/day |
Zn | 1300��g/day |
Cr | 1100��g/day |
�ߡ������īI
1�������A���͇�ˎƷ�������������A���͇���ϯ���45̖��
2����ˎƷ��������ʩ�l���������A���͇�����Ժ���360̖��
3����ֱ�ӽ��|ˎƷ�İ��b���Ϻ����������k����������ʳƷˎƷ�O(ji��n)�����������13̖��
4��ˎ���������Ϻ�����ָ��ԭ�t��������Ҋ�壩
5������ˎ��<1660>������(n��i)�����������u��ָ�ϣ�������Ҋ�壩
6�����WˎƷע�䄩�c���ϰ��b�����������о����gָ��ԭ�t��ԇ�У�����ʳˎ�O(ji��n)ע��2012��267̖��
7��ICH Q3D Guideline for Elemental Impurities.
8��Identification and Classification of Nonconformities in Molded and Tubular Glass Containers for Pharmaceutical Manufacturing.
https://store.pda.org/ProductCatalog/Product.aspx?ID=2069














